

作者简介
童 芳:复旦大学脑科学研究院博士研究生
韩清见:复旦大学脑科学研究院研究员
夏日里,公园的树荫下常可以看到一些老人围坐在一起聊天、下棋或喝茶。如果你稍加留意,会发现有些老人总是不自觉地拿起“痒痒耙”,不停地挠着手臂、背部或腿部。瘙痒是一种常见的躯体感觉,几乎每个人每天都会痒上那么几次,但痒到耙不离手的程度,背后肯定有深层的原因。这就是我们今天要向大家介绍的“老年性瘙痒”。
所谓“老年性瘙痒”,是指60岁及以上的老年人,出现无明显皮疹、持续6周以上的局部或全身性瘙痒。长期反复的瘙痒不仅会严重影响老年人的睡眠质量、情绪稳定和生活舒适度,还可能导致皮肤损伤、感染等一系列健康问题。此外,持续的瘙痒也可能引发焦虑、抑郁等心理困扰,进而影响老年人的社交生活。那么,为什么老年人更容易出现这种烦人的瘙痒症状呢?近年来的几项研究逐渐揭示了“老年性瘙痒”背后的神经生物学机制。
【瘙痒究竟是怎么回事?】
瘙痒是一种诱发搔抓欲望或搔抓反射的不愉快感觉。急性瘙痒作为机体的一种自我防御机制,能够提示个体存在伤害性刺激,并通过搔抓来清除这些刺激,从而起到保护作用。
瘙痒的产生主要是由致痒物质激活分布在皮肤或粘膜中的瘙痒受体。常见的致痒物质包括组氨、血清素、氯喹、β-丙氨酸等一些化学物质和毛发等一些物理因素,瘙痒受体能够响应这些致痒物质的刺激,并将外界的刺激信号转化为神经元内部的信号。根据致痒物质的性质不同,瘙痒可分为化学性瘙痒和机械性瘙痒,且不同的致痒物质激活的受体也各不相同。目前,已有多种瘙痒受体被鉴定出来,如组胺受体H1R和H4R、氯喹受体Mrgpr A3(Mas-related G-protein-coupled receptor A3)、β-丙氨酸受体Mrgpr D、血清素受体HTR7和HTR2、机械性瘙痒受体Piezo2等(图1)[1]。这些瘙痒受体在被外界致痒物质激活后,会将“痒”信息转化为神经元内部的化学或电信号,传递到脊髓和大脑的神经元,并最终在大脑中被解析为“痒”的感觉。
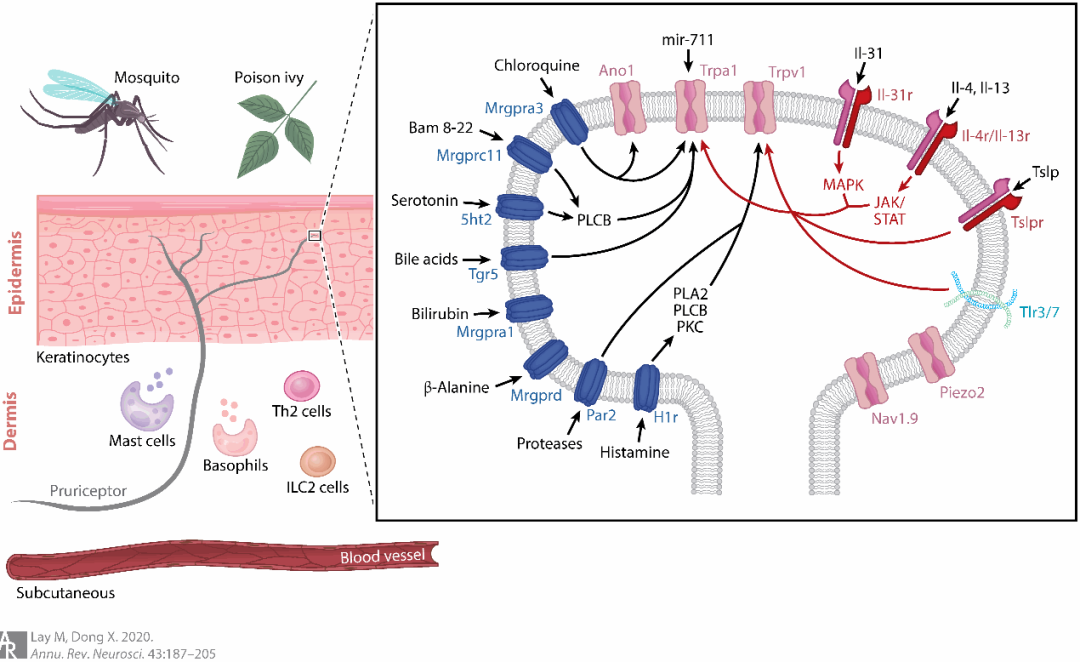
图1. 皮肤中神经末梢上的瘙痒受体。(Lay et al., Annu Rev Neurosci, 2020)
瘙痒的产生、传递和形成过程受到复杂且精密的调控,其中一个重要的调控方式是不同感觉模态对瘙痒的调节。例如,触觉刺激能够抑制瘙痒。其机制在于,触觉刺激激活低阈值机械感受器(Low Threshold Mechanical Receptors, LTMRs)。这些LTMRs不仅将触觉信息传递至脊髓,并进一步传送至大脑,同时还激活了脊髓中抑制痒觉传递的神经元(如NPY+神经元),从而抑制瘙痒的形成[2]。
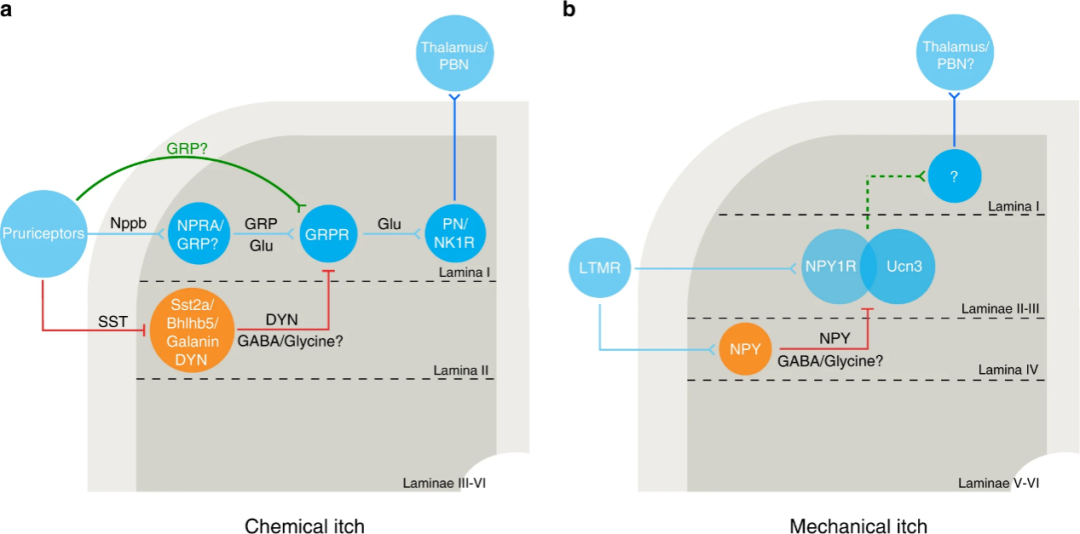
图2. 瘙痒传递的神经环路。 (Chen et al., Nat Commun, 2020)
【干皮病患者更易“痒”】
干燥的皮肤容易出现裂口,导致局部神经末梢暴露,这种暴露进一步促使瘙痒信号的传导。此外,干皮病患者的皮肤表面缺乏足够的水分和脂质,进一步加剧了皮肤屏障功能的衰退,从而使老年人对环境中的物理和化学刺激变得更加敏感。除了应对环境中的微小刺激变得更加困难外,干燥的皮肤还容易发生细菌感染或其他并发症,这些因素共同加重了老年性瘙痒的程度。
【Merkel细胞与老年性瘙痒】
Merkel细胞是皮肤中一种特殊的感受器细胞,主要位于表皮和真皮的交界处,负责感知轻微的触觉刺激。这些细胞对外界的机械性刺激(如轻触或压力)非常敏感,能够传递细腻的触觉信息。2018年,胡宏镇教授团队的研究发现,随着年龄增长,皮肤中的Merkel细胞逐渐丧失或功能衰退,这导致个体对轻微触觉刺激的感知减弱,抑制瘙痒的机制受到影响,从而增加了老年性瘙痒的发生[3]。
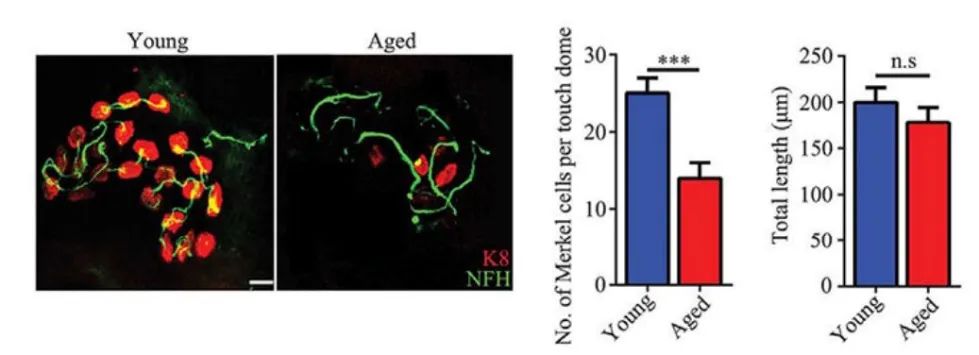
图3. 老年皮肤中Merkel细胞丢失。(Feng et al., Science, 2018)
除了Merkel细胞的丧失,最新研究还表明,干皮病的皮肤中,瘙痒感知神经末梢和Merkel细胞之间形成的错误连接。正常情况下,Merkel细胞感知触觉刺激,并把触觉信号经脊髓传递到大脑。然而,干皮病的发生使这些默克尔细胞和瘙痒相关神经末梢形成“错误连接”,导致触觉刺激诱发瘙痒的产生。这种“错乱”的神经信号传递机制是老年性瘙痒的一个关键因素,它使得老年人即使在面对正常的触觉刺激时,也会产生瘙痒[4]。
【锌离子浓度与老年性瘙痒】
锌离子(Zn²⁺)是人体中的一种重要的微量元素,尽管它只占体内总元素量的一小部分,但在生物体的许多关键生理过程中扮演着至关重要的角色,尤其在神经系统、免疫系统、细胞代谢和组织修复方面发挥着不可替代的作用。特别是锌离子对神经元的功能调控,它在神经信号的传递、神经元的兴奋性和突触可塑性方面的作用,逐渐为研究者所重视。
我们的研究表明,锌离子的浓度与老年性瘙痒的发生密切相关。锌离子是神经系统中一种重要的调节因子,它通过影响神经传导和神经兴奋性来调控各种感觉信息的传递。背根神经节(Dorsal root ganglion, DRG)神经元是皮肤感觉信号传递的“中转站”,它们负责将来自皮肤的信号(包括触觉、痛觉和瘙痒)传递到脊髓,并进一步传递到大脑。在正常状态下,DRG神经元中的锌离子浓度受到精确控制,但在老年人或皮肤干燥等情况下,这种平衡被打破了,聚集大量锌离子。当皮肤受到轻微刺激时,锌离子会被释放到脊髓突触间隙中。抑制脊髓中“NPY⁺中间神经元”,导致瘙痒传递神经环路去抑制和痒觉信号的放大,导致老年性瘙痒的发生[5]。
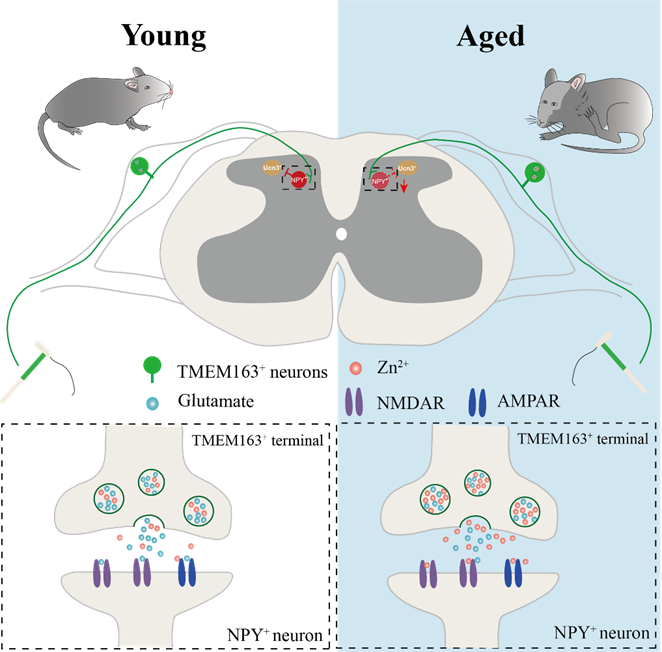
图4. 锌离子调控老年性瘙痒的发生。(Tong et al., Plos Biol, 2024)
【锌离子螯合剂或能帮忙】
锌离子螯合剂可能为缓解老年性瘙痒带来新希望,这些螯合剂能够与脊髓中多余的游离的锌离子结合,降低游离锌离子的浓度,从而削弱锌离子对瘙痒传递神经环路的去抑制作用,缓解瘙痒症状。动物实验中,使用锌离子螯合剂能够显著改善老年鼠的瘙痒症状,这为临床治疗老年性瘙痒提供了有意义的线索。
【小痒背后的大启示】
瘙痒看似是小事,但其背后的机制却涉及神经生物学的多个层面。从皮肤中感受器到DRG神经元,再到锌离子的动态调控,这些复杂的网络共同塑造了我们对瘙痒的体验。对老年性瘙痒的研究不仅帮助我们更好地理解这一现象,也为未来开发精准、高效的治疗手段带来了希望。
未来,随着基因编辑、药物研发以及对锌离子代谢的深入研究,或许有一天,老年性瘙痒将不再是长者生活中的负担,我们也将见证科学提升生活质量的又一次胜利。
Reference List
Lay M, Dong X. Neural Mechanisms of Itch. Annual Review of Neuroscience. 2020;43(Volume 43, 2020):187-205. doi: https://doi.org/10.1146/annurev-neuro-083019-024537.
Chen XJ, Sun YG. Central circuit mechanisms of itch. Nat Commun. 2020;11(1):3052. Epub 20200616. doi: 10.1038/s41467-020-16859-5. PubMed PMID: 32546780; PubMed Central PMCID: PMCPMC7297978.
Feng J, Luo J, Yang P, Du J, Kim BS, Hu H. Piezo2 channel-Merkel cell signaling modulates the conversion of touch to itch. Science. 2018;360(6388):530-3. doi: 10.1126/science.aar5703. PubMed PMID: 29724954; PubMed Central PMCID: PMCPMC6114129.
Feng J, Zhao Y, Xie Z, Zang K, Sviben S, Hu X, et al. Miswiring of Merkel cell and pruriceptive C fiber drives the itch-scratch cycle. Sci Transl Med. 2022;14(653):eabn4819. Epub 20220713. doi: 10.1126/scitranslmed.abn4819. PubMed PMID: 35857641; PubMed Central PMCID: PMCPMC9888006.
Tong F, Liu S, Zhang C, Gu X, Yang H, Zhou B, et al. Elevated vesicular Zn2+ in dorsal root ganglion neurons expressing the transporter TMEM163 causes age-associated itchy skin in mice. PLoS Biol. 2024;22(11):e3002888. Epub 20241127. doi: 10.1371/journal.pbio.3002888. PubMed PMID: 39602426; PubMed Central PMCID: PMCPMC11602076.


 公共技术平台网上预约
公共技术平台网上预约
