

新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy, HIE)是指在围产期由于窒息等多种原因导致新生儿脑缺氧缺血性损伤。HIE在我国活产儿中的发病率大约为3-6‰,是导致新生儿神经系统损伤甚至死亡的主要原因之一,每年我国大约有5-10万新生儿深受HIE的困扰,严重影响患儿的生存质量,给社会和家庭带来沉重负担。由于HIE损伤导致脑内神经细胞的死亡和丢失,目前临床上只能对症处理,无任何有效治疗药物。人多能干细胞(human pluripotent stem cells,hPSCs)经过体外定向诱导分化,可获得脑区特异性命运决定的神经前体细胞(human neural progenitor cells, hNPCs)。这些hNPCs已被用于移植治疗多种神经系统疾病(如:帕金森氏病,癫痫等),在小动物、非人灵长类以及临床研究中都展现出较好的安全性和有效性。目前,干细胞移植治疗中枢神经系统疾病已经成为了国际医药研发领域竞争的热点。相较于其他脑区的神经干细胞,人类皮层神经干细胞具有更强的增殖能力,能够分裂产生更多数量和更大多样性的皮层神经元,这被认为是人类进化过程中,新皮层的扩张和皮层沟回形成,进而导致智力和认知功能提高的细胞基础。在皮层损伤的神经系统疾病的干细胞治疗研究中,皮层神经干细胞或前体细胞移植后,往往会有过度增殖的现象,产生占位较大的移植块,对宿主脑组织形成挤压。同时移植块中还会存在多种不同发育阶段的神经细胞,包括未成熟的神经前体细胞,神经母细胞和不同类型的神经元,给移植结果带来了不确定性。因此,通过移植人皮层神经前体细胞替代治疗脑中风/缺氧缺血性脑病等与大脑皮层损伤相关的神经疾病,仍然存在挑战。
2024年11月13日,复旦大学脑科学研究院熊曼研究员,在《干细胞研究与治疗》(Stem Cell Research & Therapy)杂志发表题为“Transplanted deep-layer cortical neuroblasts integrate into host neural circuits and alleviate motor defects in hypoxic-ischemic encephalopathy injured mice(移植的深层皮层神经母细胞整合到宿主神经环路并改善缺氧缺血性脑病小鼠的运动功能缺陷)”的研究论文。该研究发现,使用Notch信号通路抑制剂将hNPCs同步化为跳出细胞周期的神经母细胞(neuroblast),进行移植,移植的神经母细胞在HIE脑内不仅可较好的存活,发育为命运确定的皮层深层的神经元类型,且完全消除了移植块过度增殖的现象。更重要的是,移植的人皮层神经元可整合入宿主的皮层神经环路,投射至内源的靶标部位(对侧皮层、丘脑、纹状体、脑干等),且可接受宿主神经元的功能调控,从而改善HIE损伤动物的运动功能障碍。
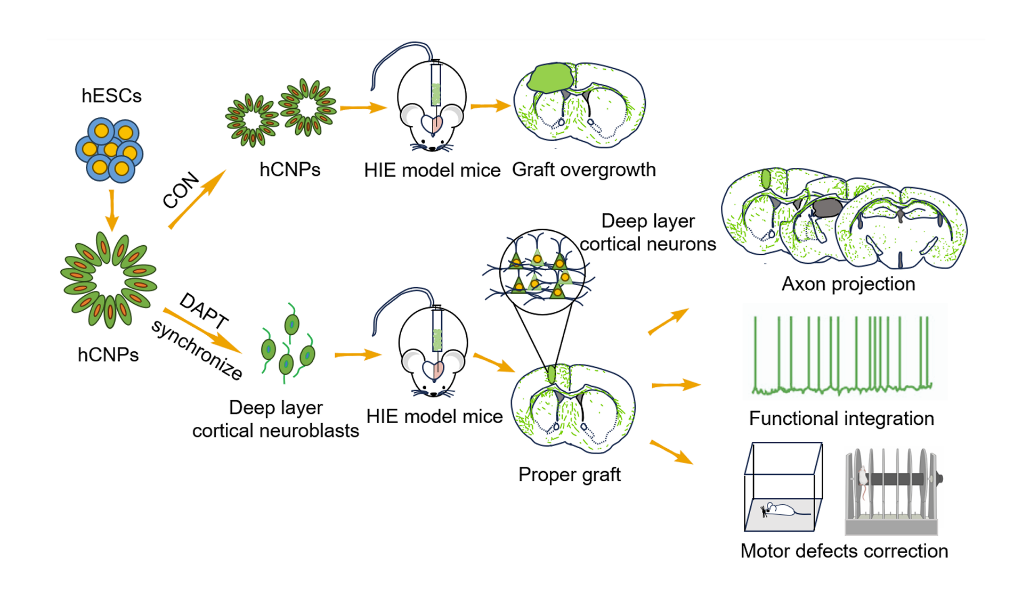
该治疗新策略不仅证明了移植人多能干细胞来源的皮层神经元可在结构和功能层面准确修复缺氧缺血性脑病受损的皮层神经环路,且有效降低了移植物过度增殖的风险,极大提高了干细胞移植治疗的安全性。该研究为脑中风/缺氧缺血性脑损伤等神经系统疾病的细胞替代治疗提供了一种更安全、更具转化应用潜力的治疗新策略。
复旦大学脑科学研究院2021级硕士研究生许愿、复旦大学附属儿科医院2021级硕士研究生武梦楠为本文的共同第一作者,熊曼研究员为通讯作者。此外,本研究受到复旦大学脑科学研究院肖雷研究员、中国科学院脑智卓越中心陈跃军研究员在电生理、动物行为等方面的帮助。本研究得到了国家自然科学基金优秀青年项目、上海市青年学术带头人项目、复旦大学基础研究特区计划等多个项目的支持。
熊曼 许愿 撰文
论文地址:https://doi.org/10.1186/s13287-024-04049-9








 公共技术平台网上预约
公共技术平台网上预约
