

严重感染和脓毒症患者常出现以体温下降、心血管功能抑制、活动减少为特征的“低代谢状态”(hypometabolism)。这种现象被认为可能是机体在炎症失控状态下的短暂适应性保护反应,但临床上往往伴随多器官功能衰竭及较高的死亡风险,其背后的中枢神经机制迄今尚不明确。
近日,复旦大学脑科学研究院/脑功能与脑疾病全国重点实验室许智祥课题组联合复旦大学附属华山医院重症医学科宫晔团队,发现了位于中脑导水管腹外侧区(vlPAG)至延髓孤束核(NTS)的一条兴奋性环路在系统性炎症诱导低代谢状态中发挥关键作用。该研究以 “An excitatory circuit in the ventrolateral periaqueductal gray drives hypometabolic state during acute systemic inflammation(中脑导水管腹外侧区的兴奋性神经环路驱动急性系统性炎症诱导的低代谢状态)”为题,发表在《Cell Reports》上。
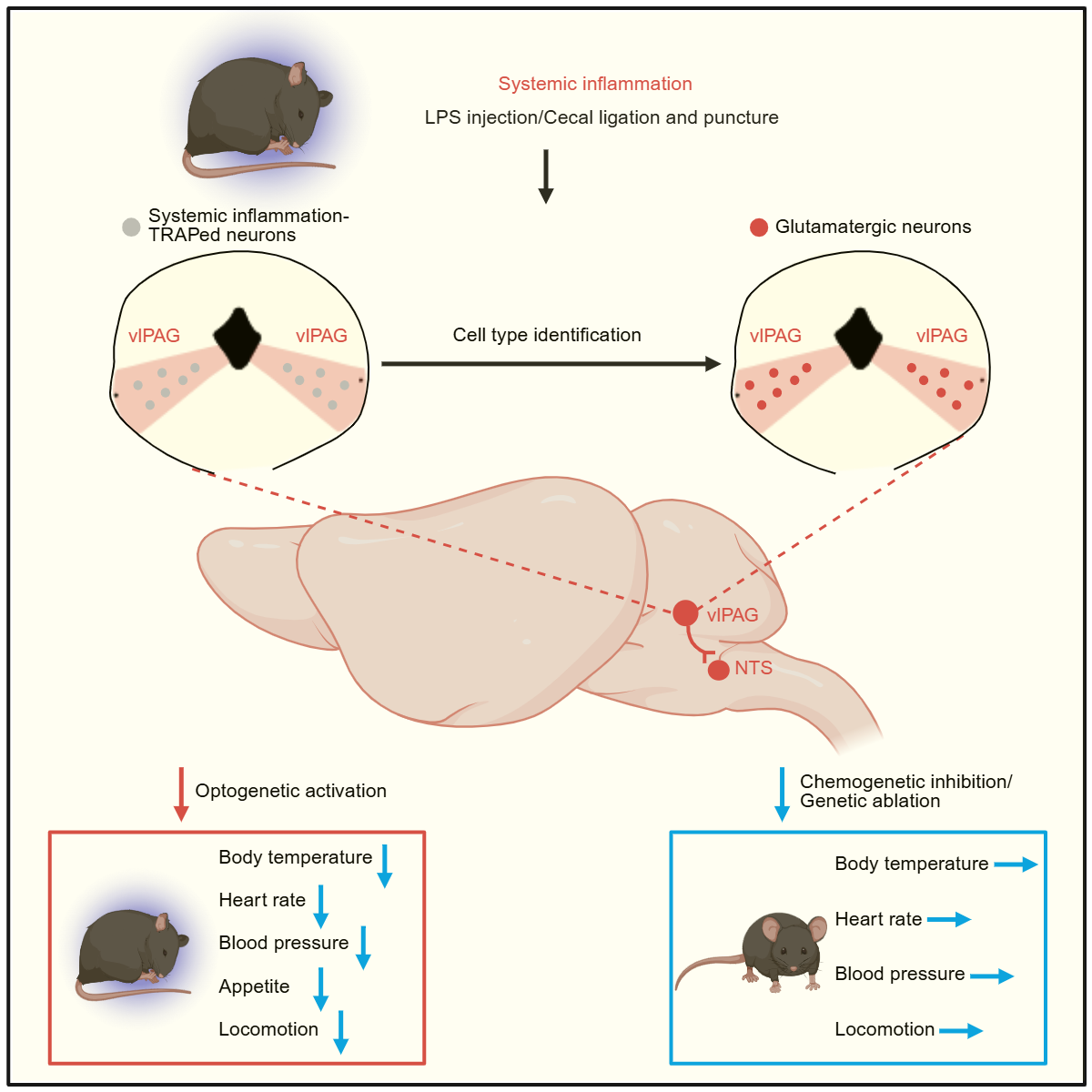
研究团队以脂多糖(LPS)和盲肠结扎穿孔术(CLP)诱导系统性炎症的小鼠模型为基础,运用TRAP标记、光遗传学激活、化学遗传学抑制、环路示踪及电生理记录等手段,证实在急性炎症期间,vlPAG的谷氨酸能神经元被显著激活,并通过向延髓NTS脑区投射,驱动低体温、心血管功能抑制以及活动减少的典型低代谢表型。进一步的功能实验表明,抑制这一通路的活动水平能有效缓解炎症导致的低代谢状态,而在非炎症状态下激活该环路则可重现低代谢症状。这一发现为深入理解炎症—代谢相互作用提供了重要的中枢神经环路证据,也为严重感染和脓毒症的临床干预策略提供了新的理论支撑和潜在靶点。未来,研究团队将进一步聚焦于神经胶质细胞与神经元之间的相互作用,深入解析其在炎症诱导低代谢状态中的具体作用及分子机制。
本研究的共同第一作者包括复旦大学附属华山医院重症医学科博士研究生谢吐秀、复旦大学脑科学研究院博士研究生向家坤、华山医院重症医学科已毕业硕士研究生何宇、华山医院重症医学科田觅博士以及脑科学研究院博士研究生占伟。许智祥研究员、宫晔教授和田觅主治医师为本研究的共同通讯作者。研究得到了科技创新2030—“脑科学与类脑研究”重大项目、国家自然科学基金、上海市自然科学基金、海军军医大学基础医学院开放研究基金等基金资助。
原文链接:https://www.sciencedirect.com/science/article/pii/S2211124725011659
联系方式
地址:上海市东安路131号科研二号楼B栋(200032)
电话:021-54237641
脑科学研究院邀您建言献策,建言献策邮箱:iobs_commun@fudan.edu.cn
友情链接
快速通道
公众号
-
 复旦大学脑科学研究院
复旦大学脑科学研究院
-
 FDU脑海研航
FDU脑海研航
复旦大学脑科学研究院 版权所有








 公共技术平台网上预约
公共技术平台网上预约