

近日,复旦大学脑科学研究院杨振纲课题组在《Advanced Science》杂志上发表文章,揭示了ERK/PKA、YAP/TAZ和SHH信号通路通过相互抑制作用,共同调控大脑皮质的神经发生、胶质发生、以及进化扩张。这项研究不仅阐明了小鼠和人类大脑发育所遵循的共同保守机制,还阐明了ERK信号通路是进化过程中大脑皮质扩张的根本驱动因素。
大脑皮质是哺乳动物大脑中最复杂的结构之一,其发育过程涉及神经干细胞及其子代细胞的命运决定。经过多年的深入研究,杨振纲团队发现,小鼠大脑皮质中的放射状胶质细胞(神经干细胞)可分为三种功能特异的亚型:即产生神经元的神经干细胞(N-RG)、产生室管膜细胞的神经干细胞(E-RG)、和产生三潜能胶质前体细胞的神经干细胞(T-RG)。这些神经干细胞的命运决定受到ERK/PKA、YAP/TAZ和SHH信号通路构成的“三重信号抑制网络”精密调控,形成了一个动态平衡的发育系统。
具体而言,ERK与PKA信号通路的协同作用能够维持大脑皮质N-RG的自我更新能力,并延长其神经发生的时间,抑制YAP和SHH信号通路,从而阻止N-RG产生胶质细胞。YAP信号通路则促进E-RG生成,并使其产生大脑皮质室管膜细胞,而SHH信号通路则驱动T-RG生成,并使其持续输出三潜能胶质前体细胞,进而分化为星形胶质细胞、少突胶质细胞和嗅球中间神经元。这种精密的信号交叉抑制机制确保了大脑皮质在正确的时间产生正确类型的细胞。
尤为重要的是,研究团队发现人类大脑皮质的外层放射状胶质细胞(oRG)通过增强ERK/PKA信号、抑制YAP和SHH通路,能够维持更长时间的自我更新与神经发生。这是人类大脑皮质在进化过程中显著扩张的关键机制。这一发现很好地解释了为何人类大脑皮质可以产生160亿的神经元,而猩猩却只有80亿,猕猴17亿。该研究首次提出了“三重信号抑制网络”模型,统一解释了哺乳动物大脑皮质的发育与进化基本规律。
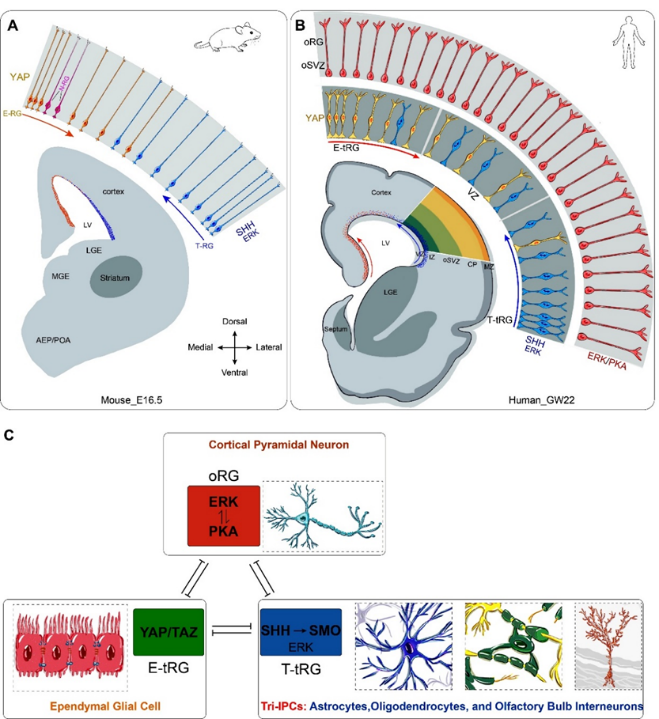
杨振纲说,本研究确立了一个全新的概念:ERK信号通路是大脑皮质发育与进化扩张的“主调控因子”,其核心地位如同细胞周期蛋白-CDK复合物在细胞周期中的作用。当然,其他信号也可能对皮质扩张有所贡献,但我们认为大部分通路很可能最终汇聚于ERK信号。在进化过程中,ERK信号在放射状胶质神经干细胞中的不断增强,通过以下机制驱动大脑皮质扩张:(1) 扩大放射状胶质细胞库(干细胞库);(2) 通过抑制胶质生成通路来延长神经发生周期;(3) ERK活性在大脑前部富集,从而优先促进前额皮质的发育扩张。
本研究是该领域的一项重要原创贡献,作者诚挚欢迎学界同仁的严格验证与建设性评论。
脑科学研究院张壮志、许哲军副研究员和博士研究生付统业、李佳霖为共同第一作者。杨飞鸿、杨川楠、郑文慧、沙子卓、高燕京、孙梦鸽、李珍美玉、李晓甦等团队成员同样做出重要贡献。该研究还得到中山医院丁晶教授的帮助。杨振纲教授为通讯作者。该项目得到国家科技部和国家自然科学基金委的资助。
原文链接:
https://doi.org/10.1002/advs.202513571








 公共技术平台网上预约
公共技术平台网上预约
