复旦大学脑科学研究院/脑功能与脑疾病全国重点实验室张玉秋教授团队于2025年7月3日,在Nature Communications期刊发表题为“Descending projection neurons in the primary sensorimotor cortex regulate neuropathic pain and locomotion in mice(初级感觉运动皮层下行投射神经元调控小鼠神经病理性痛与运动功能)”的研究论文,揭示了初级感觉运动皮层调控神经病理性疼痛和运动控制的特异性神经元亚群及其环路机制。
通过病毒示踪、在体双光子成像、光遗传学和化学遗传学操控等实验技术,研究团队在初级感觉运动皮层(SM1)深层(第5/6层)鉴定出两群相互独立的谷氨酸能神经元亚群,即SM1PAG和SM1RVM,它们分别投射到中脑导水管周围灰质(PAG)和延髓头端腹内侧区(RVM)。尽管这两群神经元的空间分布及其下行投射的解剖部位和电生理特性迥异,但在痛觉感知和运动控制功能上展现出惊人的相似性和协同性。在坐骨神经慢性压迫(CCI)诱导的神经病理性痛模型小鼠,选择性激活其中任何一群神经元(SM1PAG或SM1RVM)或其下行通路(SM1→PAG或SM1→RVM),均能显著缓解神经病理性痛,若同时激活这两群神经元可产生更为强大的镇痛效应。相反,利用Cre-Off策略选择性激活除这两群神经元以外的其他SM1神经元,可直接触发小鼠痛觉敏化。这些实验构建了完整的证据链,即激活SM1某些特定的神经元亚群能缓解疼痛,而刺激周围其他神经元反而促进疼痛,这一发现为精准镇痛提供了重要线索。
对上述两群神经元及其下行投射环路的进一步解析证明,SM1→PAG投射通过激活PAG内vGlut2阳性的兴奋性谷氨酸能神经元,进而驱动蓝斑(LC)去甲肾上腺素能神经元和RVM 5-羟色胺能神经元,最终在脊髓水平通过肾上腺素受体(如α2AR)和5-羟色胺受体(如5-HT3R 和5-HT7R)信号抑制伤害性信息传递;SM1→RVM通路则直接激活RVM内Penk阳性的脑啡肽能神经元,进而作用于脊髓μ阿片受体发挥镇痛作用。这两条通路在缓解神经病理性痛中具有等效且协同的作用。
本研究的另一个发现是,这两群SM1神经元在正常生理状态下对躯体感觉刺激反应微弱,却在运动中(如转棒)被强烈激活。选择性抑制这两群神经元对躯体感觉刺激诱发的反射性行为无影响,但可损害小鼠的精细运动和运动协调。更为重要的是,该研究进一步揭示这两群SM1神经元在“运动镇痛”(Exercise-induced analgesia)中所扮演的重要角色。实验证明,执行运动任务(如转棒)能有效缓解小鼠神经病理性痛,该效应可被选择性抑制SM1PAG或SM1RVM神经元完全阻断。这些结果表明,运动可通过特异性激活这两群SM1神经元及其下行PAG/RVM通路发挥镇痛作用,从而揭示了“越动越不痛”的神经机制。
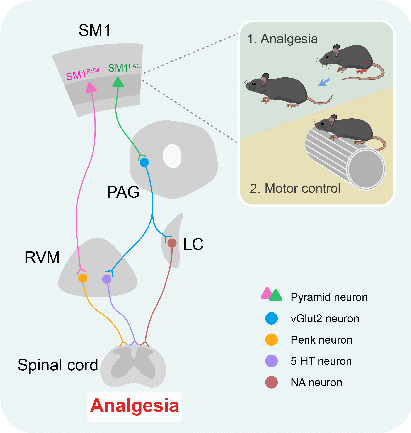
SM1神经元亚群介导镇痛和运动调控的机制示意图
复旦大学脑科学研究院张玉秋课题组博士后王国宏为本文第一作者,张玉秋为本文通讯作者。张玉秋课题组侯心宇、刘慧珠、周子睿、吕粟粟、易蓝星、李荟等同学参与协助课题完成。该研究得到了科技部2030—“脑科学与类脑研究”重大项目和国家自然基金等项目的支持。
原文链接:https://www.nature.com/articles/s41467-025-61164-8