

近年来,淋巴细胞来源的IL-17A在病理性疼痛中的作用及其性别二态性的研究已有报道,但中枢IL-17A的来源和调控机制仍不清楚。复旦大学脑科学研究院/脑功能与脑疾病全国重点实验室张玉秋课题组与复旦大学附属华山医院徐文东教授合作,于2024年12月17日,在Acta Pharm Sin B杂志上发表题为 “Spinal astrocyte-derived interleukin-17A promotes pain hypersensitivity in bone cancer mice(脊髓星形细胞来源的白细胞介素-17A促进骨癌小鼠的痛觉敏化)”的研究论文,揭示抑制脊髓星形胶质细胞活化能够降低骨癌引起的脊髓IL-17A水平上调,缓解骨癌痛,该效应对不同性别小鼠具有普适性。
由恶性肿瘤引起的癌痛是临床上最严重的病理性疼痛,在进展期和晚期肿瘤患者中,半数以上患者伴有重度疼痛,特别是骨癌引起的疼痛。尽管依据WHO倡导的对癌痛患者的三阶梯疗法取得一定成效,但由于癌痛发生机理尚不清楚,治疗仍是采用与以往对其他类型慢性痛(如炎性痛和神经病理性痛)治疗类似的手段,很多患者癌痛症状无法得到有效控制。揭示骨癌痛的发生和维持机制,寻找更为有效的癌痛治疗手段成为迫切需要解决的问题。近年来,慢性痛的非神经机制越来越多地引起人们的重视。已有研究报道,脊髓胶质细胞激活参与神经病理性疼痛的发生和发展,且具有性别二态性。然而,脊髓星形胶质细胞和小胶质细胞对骨癌痛的作用尚存有争议。
本研究通过在小鼠股骨骨髓腔内接种Lewis肺癌细胞构建小鼠骨癌模型。模型小鼠受累骨骨髓质和骨皮质逐步破坏,荷瘤侧后肢出现明显的热痛过敏和触诱发痛,持续整个实验过程(28天);与此同时,脊髓背角星形胶质细胞持续激活,并伴有促炎性细胞因子白细胞介素17A(IL-17A)表达水平上调;但在骨癌发生和发展过程中(肿瘤接种后1-28天)未见小胶质细胞发生明显改变(在炎症痛和神经病理性痛条件下,均伴有脊髓背角小胶质细胞的大量激活)。上述变化在雌雄小鼠间无明显差异,提示骨癌痛的发生和维持机制具有其特殊性,并非像以往认为的只是炎症痛和神经病理性痛的集合。遗传学和药理学操控结果显示,抑制脊髓星形胶质细胞显著下调IL-17A,改善骨癌引起的痛敏行为;选择性抑制星形胶质细胞来源的IL-17A或特异性阻断表达于脊髓神经元的IL-17A受体(IL-17RA)亦可有效改善骨癌痛;光遗传学激活脊髓星形胶质细胞或选择性地在脊髓星形胶质细胞过表达IL-17A可直接诱发痛觉敏化行为。研究进一步揭示,脊髓星形胶质细胞释放的IL-17A可通过表达在神经元的IL-17RA-pCaMKIIα信号通路介导脊髓中枢敏化。
该项研究表明,IL-17A作为胶质细胞与神经元相互作用的重要信号分子,可能成为骨癌痛治疗的新靶点。该研究对于揭示骨癌痛的中枢敏化机制和探索具有普适意义的治疗骨癌痛的新靶点都具有重要意义。
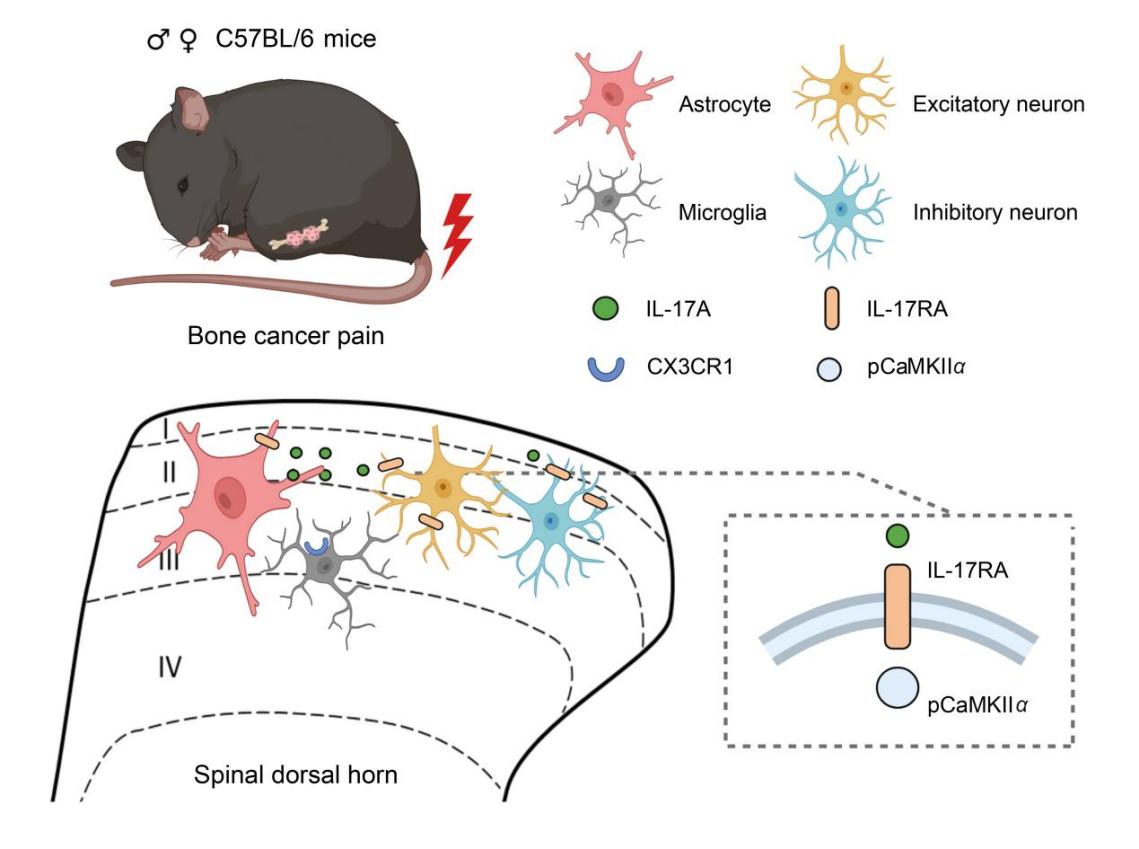
脊髓星形胶质细胞释放IL-17A增强脊髓伤害性信息传递促进骨癌痛的示意图
张玉秋课题组博士后刘慧珠博士为该论文第一作者,张玉秋教授、徐文东教授和吕宁副研究员为本文共同通讯作者。本研究得到国家自然科学基金委重点项目和创新群体项目支持。
全文链接:https://doi.org/10.1016/j.apsb.2024.09.016








 公共技术平台网上预约
公共技术平台网上预约
